—— PROUCTS LIST
徠卡超高分辨顯微技術-病毒學相關研究應用
由於(yu) 受到光學衍射極限的限製,普通光學顯微鏡分辨率隻能達到200nm,而通常病毒和亞(ya) 細胞結構的尺寸隻有幾十到200多納米,遠遠小於(yu) 普通光鏡的分辨率。超高分辨顯微技術的出現,為(wei) 觀測這類精細結構提供了可能,因此也得到了越來越廣泛的應用。作為(wei) 超高分辨技術的,受激發射損耗(STimulated Emission Depletion, STED)技術更是在生命科學領域尤其是病毒學相關(guan) 研究中發揮著重要作用。
本次為(wei) 大家分享STED技術在病毒學研究中的應用和新進展,助力生命科學研究和發展。
STED基本原理
2014年諾貝爾化學獎授予三位科學家,以表彰他們(men) 發明超高分辨顯微技術。其中Stefan Hell發明了STED技術,而徠卡公司也是*將其商業(ye) 化。從(cong) 2007年開始,徠卡STED產(chan) 品不斷創新和優(you) 化,已經擁有近13年的STED技術積累。2014年*推出SP8 STED 3X,即榮獲當年的R&D100大獎。2019年更是創新性的推出了τ-STED,進一步在提升分辨率的同時降低了激光功率,更適合活細胞超高分辨成像。

2014年諾貝爾化學獎獲得者,左起分別是:Eric Betzig、Stefan W. Hell、William E. Moerner
說了這麽(me) 多,STED技術原理到底是什麽(me) 呢?很簡單。我們(men) 想象一下,一個(ge) 點發射出的熒光信號,被檢測後通常是一個(ge) 衍射斑;如果我們(men) 同時使用一個(ge) 甜甜圈樣的激光將其周圍的信號擦除掉,隻允許中心很小的熒光信號發射出來,這樣分辨率不就提高了嗎。這個(ge) 起擦除作用的激光便是STED激光,也叫損耗光,利用的是熒光的受激發射損耗原理。之後,通過對圖像的掃描,即可直接呈現超高分辨圖像,無需任何後續計算過程。同時,根據公式,可通過增加STED激光功率來提升圖像分辨率。
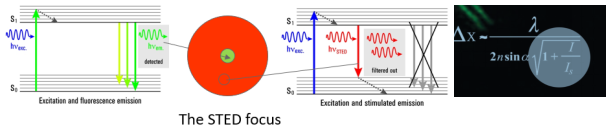 STED原理示意圖:STED通過受激發射損耗去除衍射環上的熒光信號,大大縮小有效的激發區域,從(cong) 而改寫(xie) 了分辨率公式,提高了光學分辨率
STED原理示意圖:STED通過受激發射損耗去除衍射環上的熒光信號,大大縮小有效的激發區域,從(cong) 而改寫(xie) 了分辨率公式,提高了光學分辨率
STED技術在病毒學研究中的應用實例
01
*應用實例,是對病毒精細結構的觀察。2012年發表在期刊science上,標題為(wei) :熒光納米顯微鏡(STED)揭示成熟依賴的HIV-1病毒表麵蛋白的再分布特征【1】。
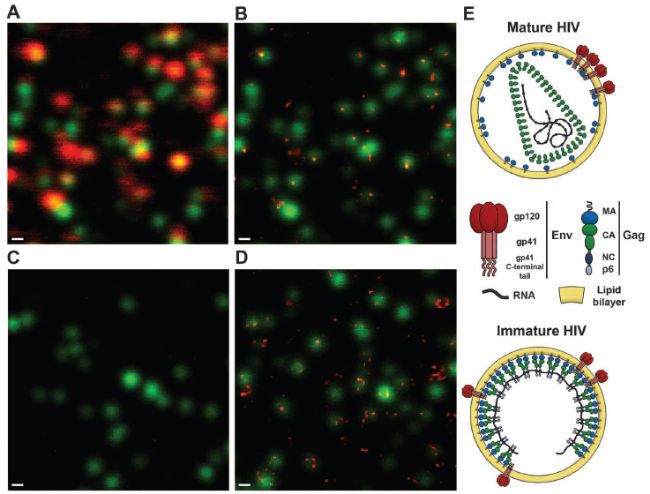
圖中綠色代表HIV-1病毒粒子,紅色表示病毒表麵的膜蛋白。可以看到,通過普通共聚焦無法分辨膜蛋白的具體(ti) 定位位置,很模糊。包膜糖蛋白gp120(紅色)與(yu) 病毒粒子(綠色)90%共定位,信號模糊,分辨不出細節。而STED成像可以發現,大多數成熟病毒粒子表現出單一的包膜蛋白Env或焦點(圖1B),而大多數未成熟粒子表現出兩(liang) 個(ge) 或兩(liang) 個(ge) 以上的包膜蛋白Env(圖1D)。
02
第二個(ge) 應用實例,是對病毒成熟過程的觀察。標題為(wei) :STED納米顯微鏡揭示HIV病毒蛋白水解成熟的時間過程【2】。
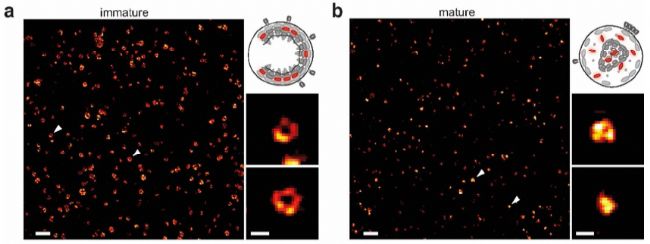
利用STED顯微鏡發現在HIV-1病毒成熟和未成熟條件下,可非常清晰區分其Gag蛋白的不同結構特征。未成熟病毒的Gag蛋白呈中空環狀(圖a),而成熟病毒中呈實心固縮狀(圖b)。

作者巧妙的利用光控方法,進行STED時間序列成像。在400nm紫外光照後,PDI(光催化降解的蛋白酶抑製劑)降解,Gag蛋白能夠被蛋白酶水解切割,進而病毒成熟。STED時間序列成像可輕鬆捕獲病毒從(cong) 未成熟到成熟過程,Gag蛋白重排的結構變化過程。
03
第三個(ge) 應用實例,是對病毒基因組示蹤。標題為(wei) :以單分子分辨率示蹤宿主細胞中的病毒基因組【3】。
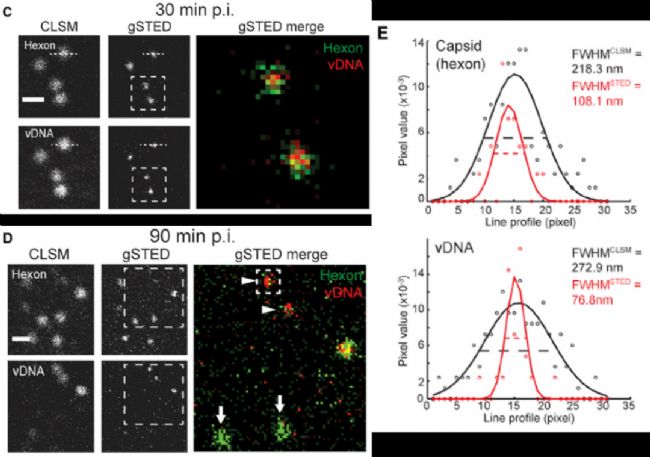
腺病毒DNA通過AF594標記的疊氮點擊反應顯示,衣殼蛋白通過抗hexon的抗體(ti) 識別,並且隻有在脫殼後,病毒DNA才可以被反應檢測到熒光信號。
通過gated STED超高分辨顯微成像,可顯著提高分辨率,清晰呈現病毒衣殼和DNA的真實尺寸大小。腺病毒衣殼實際大小約80nm,gSTED顯示約110nm(包含一二抗尺寸),與(yu) 實際一致。gSTED顯示被衣殼蛋白包裹的病毒DNA尺寸略小於(yu) 80nm,也與(yu) 衣殼尺寸符合。
04
第四個(ge) 應用實例,是對病毒基因組複製的觀察。標題為(wei) :利用STED超高分辨顯微鏡觀察複製的HSV-1病毒【4】。值得一提的是,本文由中科院昆明動物所周巨民老師課題組與(yu) 徠卡公司合作完成。

病毒基因組複製是單純皰疹病毒 1 (HSV-1) 溶解感染周期的重要事件。目前由於(yu) 檢測和觀察方法的局限,病毒複製過程的細節仍難以捕捉。為(wei) 了獲得更加詳細的 HSV-1 複製機製,本文使用了STED受激發射損耗顯微鏡,結合熒光原位雜交 (FISH) 和免疫熒光,對HSV-1 複製過程進行了精細觀察。
作者設計了位於(yu) HSV-1病毒基因組兩(liang) 端的探針,分別以DIG(綠色)和Biotin(紅色)進行標記,在病毒複製的早期和晚期,分別成像觀察。STED成像發現,在複製的早期,紅綠兩(liang) 色信號的共定位程度較高;而在複製後期,兩(liang) 個(ge) 係數均發生了明顯降低,表明HSV-1 基因組在複製過程中經曆了從(cong) 緊湊到鬆弛的動態結構變化,同時需要占用較大的空間進行複製。
05
第五個(ge) 應用實例,是對病毒侵染和傳(chuan) 播過程捕獲的研究。標題為(wei) :ARP2和病毒誘導的絲(si) 狀偽(wei) 足促進了人類呼吸道合胞體(ti) 病毒的傳(chuan) 播【5】。
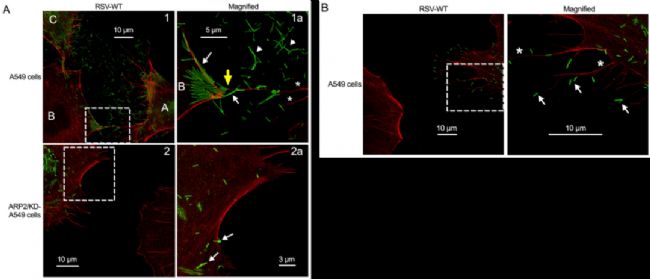
利用STED超高分辨顯微鏡進行成像,發現感染了RSV病毒的細胞(圖A首行,標記為(wei) A和C)外存在大量的絲(si) 狀偽(wei) 足(紅色),且富集有大量病毒顆粒(綠色);暗示可通過絲(si) 狀偽(wei) 足將RSV病毒傳(chuan) 遞給鄰近細胞。而在ARP2敲除的細胞中(圖A第二行),即便感染了RSV病毒,細胞的絲(si) 狀偽(wei) 足數量都大量減少,病毒在細胞間的傳(chuan) 播不明顯。放大圖像(圖B),可觀察到RSV病毒主要分布在絲(si) 狀偽(wei) 足的*,進一步驗證了病毒可通過誘導絲(si) 狀偽(wei) 足的產(chan) 生來促進其在細胞間的傳(chuan) 播。
如何進一步提高STED分辨率?
根據公式我們(men) 可以知道,通過增加STED激光功率就可直接增加圖像的分辨率,這個(ge) 方法簡單;但問題是不利於(yu) 活細胞成像。那麽(me) 如何在不提高激光功率的前提下,進一步提高STED分辨率呢?有以下三種方法,分別是gated STED,gated STED + Lightning,和徠卡新推出的τ-STED。
01
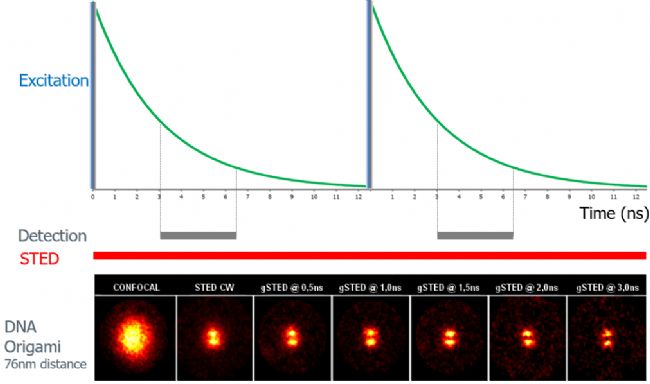
以兩(liang) 個(ge) 距離76nm的DNA Origami為(wei) 例,gated STED在不改變STED激光功率的前提下,逐步縮小熒光壽命的檢測範圍,可逐步提高分辨率,清晰地分辨兩(liang) 個(ge) 點信號。
02
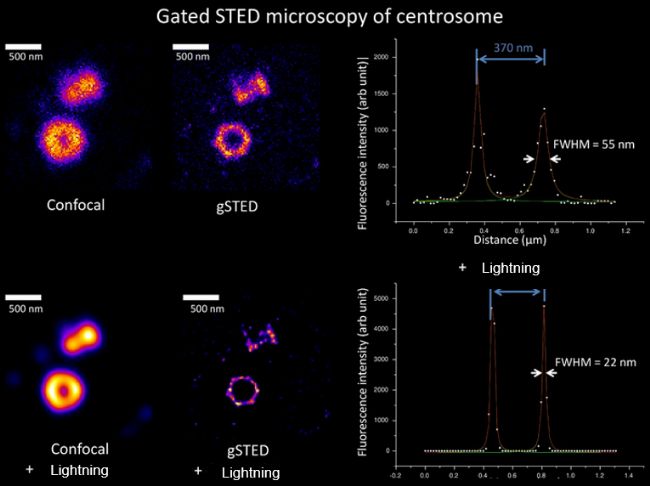
對中心粒的gated STED + Lightning成像結果,分辨率(半高寬)可達22nm!
03
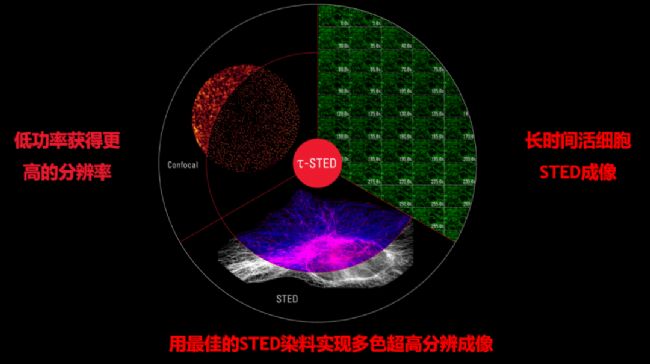
新一代STED:τ-STED,即將STED和超快速的熒光壽命相結合,實時呈現超高清分辨圖像。它在已有STED優(you) 勢的基礎上,可以更低激光功率獲得更高圖像分辨率,進一步拓展熒光染料的選擇,非常適合長時間的活細胞成像。
結語
徠卡STED擁有13年的研發、技術和服務經驗,也具有以下突出優(you) 勢特點,是病毒學研究的*利器:
“純光學"超高分辨顯微技術,所見即所得
全光譜、多色超高分辨成像,提供592nm/660nm/775nm三根 STED譜線
專(zhuan) 為(wei) STED設計的多款滿足不同應用需求的物鏡
使用常規熒光染料及熒光蛋白,製樣簡單、方便
τ-STED低光毒性,更適合活細胞超高分辨成像
快速掃描頭能夠更好的保護樣品
LAS X Navigator能夠輕鬆尋找目標視野
此外,整個(ge) STED是搭載在徠卡共聚焦平台上的,因此也擁有共聚焦的所有優(you) 點。相信徠卡STED超高分辨顯微鏡能夠更多地貢獻超高清圖像結果,助力病毒學和生命科學研究發展。
參考文獻:
【1】Chojnacki J, Staudt T, Glass B, et al. Maturation-dependent HIV-1 surface protein redistribution revealed by fluorescence nanoscopy.[J]. Science, 2012, 338(6106): 524-528.
【2】Hanne J, Gottfert F, Schimer J, et al. Stimulated Emission Depletion Nanoscopy Reveals Time-Course of Human Immunodeficiency Virus Proteolytic Maturation[J]. ACS Nano, 2016, 10(9): 8215-8222.
【3】Wang IH, Suomalainen M, Andriasyan V, et al. Tracking viral genomes in host cells at single-molecule resolution. Cell Host Microbe. 2013;14(4):468–480.
【4】Li Z, Fang C, Su Y, et al. Visualizing the replicating HSV-1 virus using STED super-resolution microscopy[J]. Virology Journal, 2016, 13(1): 65-65.
【5】Mehedi M, Mccarty T, Martin S E, et al. Actin-Related Protein 2 (ARP2) and Virus-Induced Filopodia Facilitate Human Respiratory Syncytial Virus Spread[J]. PLOS Pathogens, 2016, 12(12).

